高中化學試題
- 將紅熱的固體單質甲放入久置呈黃色的溶液乙中,劇烈反應產生混合氣體A,A在常溫下不與空氣反應。答案與解析
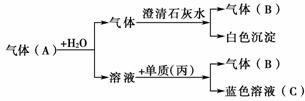
(1)試推斷:甲為________、乙為________、丙為________、
A為________、B為________、C為________。
(2)寫出甲與乙反應的化學方程式:_____________________________________。 - 關于乙醇的說法中正確的是(??)
- A乙醇結構中有—OH,所以乙醇溶解于水,可以電離出$OH^{-}$而顯堿性
- B乙醇燃燒生成二氧化碳和水,說明乙醇具有氧化性
- C乙醇與鈉反應可以產生氫氣,所以乙醇顯酸性
- D乙醇與鈉反應非常平緩,所以乙醇羥基上的氫原子不如水中的氫原子活潑
- A
- 物質的量之比為2∶5的鋅與稀硝酸反應,若硝酸被還原的產物為$N_{2}O$,反應結束后鋅沒有剩余,則該反應中被還原的硝酸與未被還原的硝酸的物質的量之比是(??)
- A晶體硅熔點高硬度大,可用于制作半導體材料
- B氫氧化鋁具有弱堿性,可用于制胃酸中和劑
- C漂白粉在空氣中不穩定,可用于漂白紙張
- D氧化鐵能與酸反應,可用于制作紅色涂料
- A
- 下列物質性質與應用對應關系正確的是()
- A晶體硅熔點高硬度大,可用于制作半導體材料
- B氫氧化鋁具有弱堿性,可用于制胃酸中和劑
- C漂白粉在空氣中不穩定,可用于漂白紙張
- D氧化鐵能與酸反應,可用于制作紅色涂料
- A
- 某實驗小組用下列裝置進行乙醇催化氧化的實驗。答案與解析
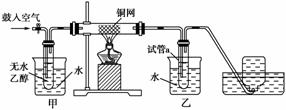
(1)實驗過程中銅網出現紅色和黑色交替出現的現象,請寫出相應的化學反應方程式:
________________________________________________________________________,
________________________________________________________________________。
(2)甲和乙兩個水浴作用不相同。
甲的作用是:
乙的作用是:
(3)反應進行一段時間后,干燥試管a中能收集到不同的物質,它們是________;集氣瓶中收集到的氣體的主要成分是________________。 - “綠色化學”對化學反應提出了“原子經濟性”(原子節約)的概念及要求.理想的原子經濟性反應中原料分子中的所有原子全部轉變成所需產物,不產生副產物,實現零排放.以下反應中最符合“綠色化學”的是( )
- A乙烯與氧氣在銀的催化作用下生成環氧乙烷
- B利用乙烯與HCl反應,制備氯乙烷
- C以苯和液溴為原料,在一定條件下生產溴苯
- D乙醇與濃硫酸共熱制備乙烯
- A
- 由乙烯和乙醇組成的混合氣體,經測定其中碳元素的質量分數為60%,則混合氣體中氧元素的質量分數為( )
- A32.00%
- B20.00%
- C26.67%
- D14.22%
- A
- 丙烯醇($CH_{2}===CH—CH_{2}OH$)可發生的化學反應有( )
①加成 ②氧化 ③燃燒 ④加聚 ⑤取代- A①②③
- B①②③④
- C①②③④⑤
- D①③④
- A
- 等質量的銅片,在酒精燈上加熱后,分別插入下列溶液中,放置片刻,銅片質量增加的是( )
- A硝酸
- B無水乙醇
- C石灰水
- D鹽酸
- A
- 下列說法中正確的是( )
- A醇在Cu或Ag的催化作用下都可以氧化
- B乙醇的分子間脫水反應屬于消去反應
- C醇都可以在濃$H_{2}SO_{4}$作用下在170℃時發生消去反應
- D一元飽和脂肪醇的化學式可以用通式$C_{n}H_{2n}$+2O表示
- A
